Sylvain Guérin, Ph.D.

Professeur-chercheur
Tél: 418 682 7511 poste 87565
This email address is being protected from spambots. You need JavaScript enabled to view it.
Formation académique
| Diplôme | Université | Domaine | Années |
| Postdoctorat | Harvard, Boston USA | Régulation génique | 03/86-10/88 |
| Ph.D. | Université Laval | Microbiologie, Faculté de Médecine | 01/83-03/86 |
| M.Sc. | Université Laval | Microbiologie, Faculté de Médecine | 05/81-12/82 |
| B.Sc. | Université du Québec à Rimouski | Biologie | 09/78-05/81 |
Intérêts de recherche
I.1. Régulation des intégrines par la matrice extracellulaire durant la cicatrisation de l’épithélium cornéen
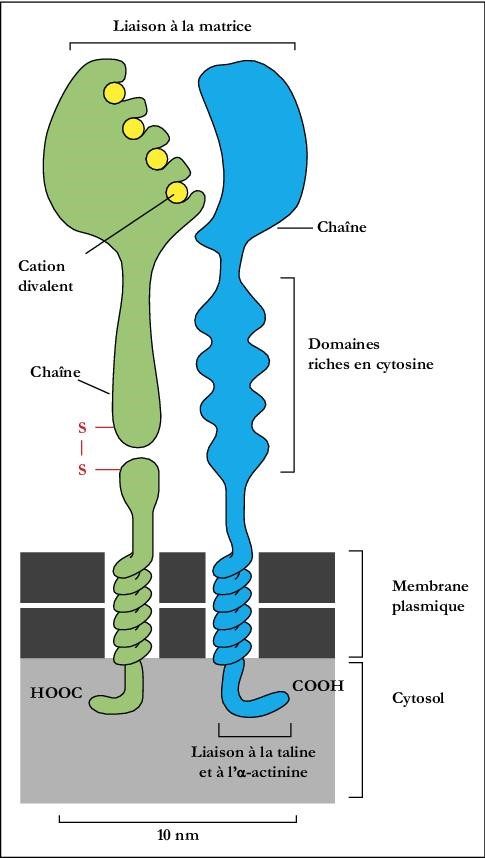
Lorsque l’épithélium cornéen est endom-magé, il s’en suit un remodelage important de la matrice extra-cellulaire (MEC) par les cellules stromales et épithéliales de la cornée. L'adhésion de l'épithélium au stroma est, en grande partie, assurée par les intégrines, une vaste famille de récepteurs membranaires constitués d’une sous-unité a associée à une sous-unité b (voir Figure 1) et pouvant lier la plupart des composantes de la MEC telles que la fibronectine (FN), la laminine (LM), les collagènes de type I (CI) et IV (CIV) et la tenascine (TN).
|
Figure 1 |
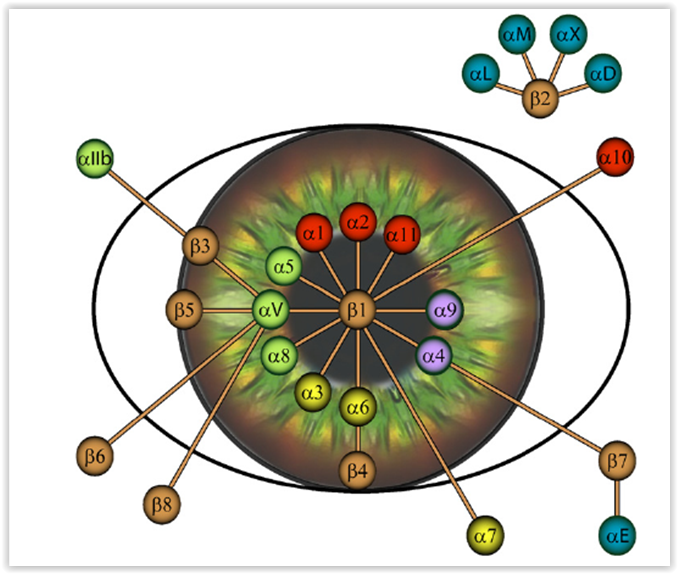 Figure 2 (Vigneault et al. (2007) PRER, 26 :99) Figure 2 (Vigneault et al. (2007) PRER, 26 :99) |
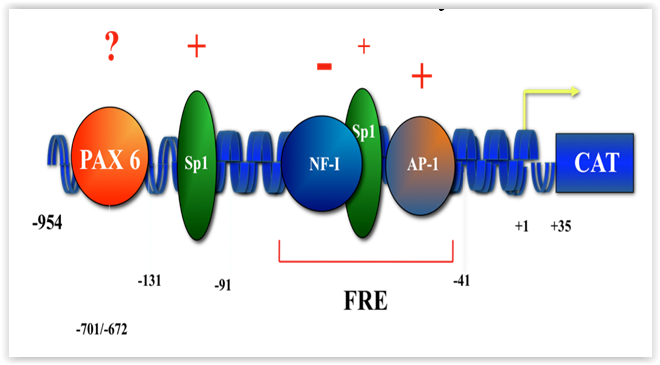
L’expression d’un nombre important d’intégrines a été rapportée dans l’épithélium cornéen (voir Figure 2). Parmi celles-ci, les intégrines a4b1 et a5b1 y représentent les principaux récepteurs FN alors que les intégrines a6b1 et a9b1 permettent respectivement l’adhésion cellulaire à la LM et à la TN. Nous croyons que leur synthèse pourrait être modifiée durant la cicatrisation cornéenne en réponse aux changements qui surviennent dans la composition de la MEC. Au cours des dernières années, nous avons donc entrepris l'étude des régions régulatrices modulant l'expression des gènes encodant les sous-unités d’intégrines a4, a5, a6 et a9. Nos travaux ont permis de démontrer la liaison de plusieurs facteurs de transcription (Sp1, Sp3, NFI, AP-1, Pax-6) à des régions cibles régulatrices portées par chacun de ces gènes (Figure 3; promoteur du gène a5). Ainsi, nous nous intéressons à l’analyse détaillée des promoteurs de ces différents gènes et à l’étude des signaux induits par la liaison de la FN, du CI/IV, de la LM et de la TN à leur récepteur respectif (FN : a5b1; CI/CIV : a2b1; LM : a6b1; TN : a9b1) en vérifiant l’inductibilité des promoteurs des gènes a4, a5, a6 et a9 vis-à-vis leur ligands (FN, CI/CIV, LM et TN).
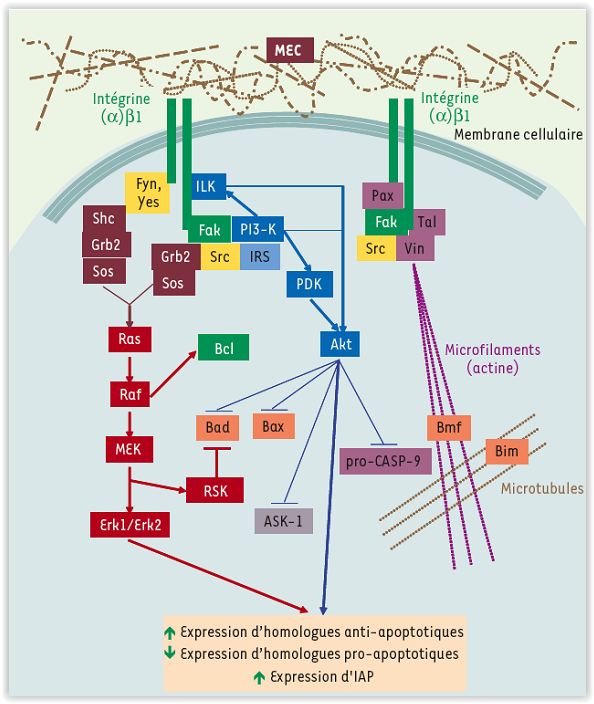
Certains aspects de ces travaux nous ont également mené à l’étude des voies signalétiques activées par la liaison de la FN à son intégrine a5b1. Nous avons ainsi démontré que la liaison de la FN à son récepteur conduit à la phosphorylation du facteur de transcription positif Sp1 par les kinases Erk1/Erk2 via l’activation de la voie des MAP-kinases (voir Figure 4).
|
Figure 3 |
Figure 4 (Vachon, PH (2006) M/S, 22 :423) |
Cette hyper-phosphorylation de Sp1 lui permet de reconnaître sa séquence cible, désigée FRE (‘fibronectin responsive element’), dans le promoteur du gène a5 avec une affinité accrue, entraînant de surcroit une importante augmentation de la transcription du gène a5 dans ces cellules. Il est donc important de poursuivre dans cette voie en identifiant les voies signalétiques activées par la liaison des autres composantes de la MEC (LM, CIV et TN) et en démontrant leur inter-relation.
I.2. Rôle des intégrines dans les propriétés du mélanome uvéal
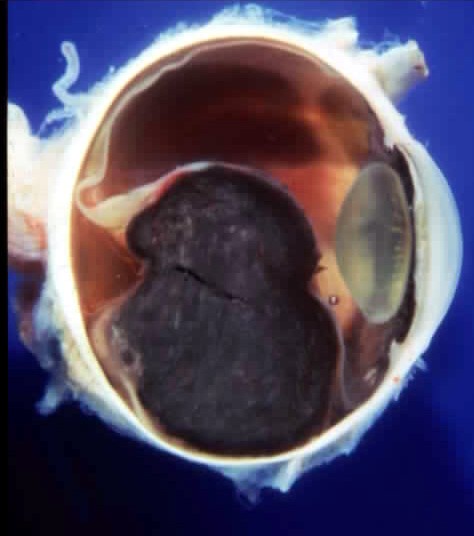
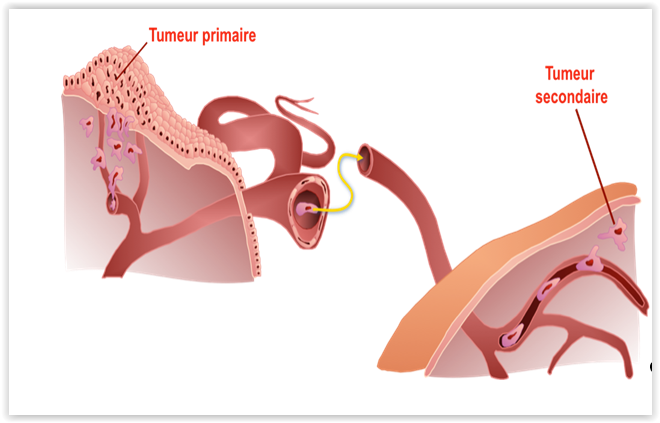
Le mélanome uvéal (Figure 5), avec une incidence annuelle de 4.3 nouveaux cas par million d’individus, représente la tumeur maligne intraoculaire la plus fréquente dans la population adulte. Selon les données rapportées dans le COM study, plus de 55%des individus atteints de cette forme de cancer développeront des métastases dans les 10 années qui suivront le dépistage de la tumeur primaire.
|
Figure 5 |
Figure 6 |
Chez plus de 90% de ces patients, le site initial de formation des métastases est le foie. Une fois le diagnostic de métastases hépatiques établi, la survie du patient est généralement inférieure à 6 mois ce qui fait du mélanome uvéal un cancer particulièrement agressif. Bien que les thérapies actuelles permettent de mieux contrôler l’évolution de la tumeur primaire en préservant l’intégrité du globe oculaire, aucune ne s’est avérée efficace afin de réduire l’apparition des lésions hépatiques. Comme avec d’autres formes de cancers, la dissémination du mélanome uvéal requiert: i) la suppression de la dépendance à l’ancrage (anoikis), ii) la dégradation de la MEC qui entoure ces cellules et iii) leur migration au foie (Figure 6).
L’attachement de la cellule à la MEC est assuré par des récepteurs appartenant à la famille des intégrines, des glycoprotéines membranaires constituées de sous-unités a et b qui s’associent pour former l’une ou l’autre des 24 intégrines connues. À ce jour, il s’est avéré difficile d’établir des corrélations entre l’expression des intégrines et l’agressivité de certains cancers. Quelques études ont observé une expression accrue des intégrines dans plusieurs types de cancers alors que d’autres rapportent plutôt leur diminution, principalement celles appartenant à la sous-famille b1. L’expression des intégrines chez le mélanome uvéal a fait l’objet de peu d’études. La plupart des tumeurs primaires expriment les sous-unités a3 et a6, mais peu a4. Toutefois, la comparaison avec des mélanocytes uvéaux normaux (UVM) a permis de démontrer que les intégrines a1b1, a4b1 et a6b1 étaient exprimées dans la plupart des lignées de mélanome uvéal analysées alors que les UVM n’exprimaient aucune de ces intégrines. Cependant, aucune étude n’a comparé le profil d’expression des intégrines entre des UVM et des cellules issues des métastases hépatiques, vraisem-blablement en raison de la difficulté à ob-tenir ce matériel biologique.
Notre intérêt s’est rapidement orienté vers une fonction potentielle exercée par les intégrines a4b1 et a5b1. En effet, des travaux que nous avons récemment réalisés sur les lignées de mélanomes uvéaux SP6.5, SP8.0, TP31, T97, T98, T108, T115 et H79 nous portent à croire que le potentiel tumorigène du mélanome uvéal serait inversement proportionnel au niveau d’ex-pression de l’intégrine a5b1. Ainsi, l’expres-sion de cette intégrine est particulièrement élevée dans les lignées peu agressives SP6.5, SP8.0, TP31, T108 et T115 alors qu’elle est fortement réprimée dans les lignées très agressives T97 et T98. De plus, il apparaît que la capacité des cellules à nidifier préférentiellement au foie des individus ayant développé un mélanome choroïdien pourrait être liée à l’expression aberrante de l’intégrine a4b1. En effet, cette intégrine, normalement absente des mélanocytes uvéaux non-néoplasiques (UVM) ainsi que des lignées ne démontrant aucun potentiel métastatique (SP6.5, SP8.0, TP31, T108 et T115), s’avère exprimée dans les lignées agressives T97 et T98 ainsi que dans la lignée H79 dérivée des métastases hépa-tiques provenant du foie d’un donneur atteint de cette forme de cancer. Il est par consé-quent essentiel de caractériser les éléments du promoteur des gènes a4 et a5 dans le but de mieux comprendre les mécanismes res-ponsables de leur expression (ou répression) anormale dans les diverses lignées de méla-nomes que nous avons à notre disposition.
Méthodologies de recherche:
Gel de rétention (EMSA) et super-rétention, culture cellulaire (épithélium cornéen, mélanome uvéal), culture bactérienne, infection lentivirale (shARN, RNAi), buvardage Western, immunoprécipitation, profilage génétique (expression génique, transcription), préparation de sondes radio-marquées, préparation d’extraits nucléaires, transfection de cellules en culture (promoteur), cartographie à la DnaseI (facteurs de transcription, Sp1, NFI, AP-1), cartographie au DMS, manipulation et utilisation de souris athymiques (cancer), essais d’adhésion cellulaire (matrice extracellulaire, intégrines).
(Vigneault et al. (2007) PRER, 26 :99)